PRIMER PRINCIPIO DE LA TERMODINAMICA.
LEY DE CONSERVACIÓN DE LA ENERGÍA
La ley de conservación de la energía, también conocida como primer principio de la termodinámica establece que “aunque la energía se puede convertir de una forma a otra no se puede crear ni destruir”. No existe ni puede existir nada capaz de generar energía, no existe ni puede existir nada capaz de hacer desaparecer la energía y por último si se observa que la cantidad de energía varía, siempre será posible atribuir dicha variación a un intercambio de energía con algún otro cuerpo o con el medio circundante.
La energía es la capacidad de los cuerpos o sistemas de cuerpos para efectuar un trabajo. Todo sistema que pasa de un estado a otro produce fenómenos físicos o químicos que no son más que manifestaciones de alguna transformación de la energía, pues esta puede presentarse en diferentes formas: cinética, potencial, eléctrica, mecánica, química.
Siempre que se produzca una cantidad de una clase de energía se deberá consumir una cantidad exactamente equivalente de otra clase o clases.
ENERGÍA INTERNA
La magnitud que designa la energía almacenada por un sistema de partículas se denomina energía interna (U). La energía interna es el resultado de la contribución de la energía cinética de las moléculas o átomos que lo constituyen, de sus energías de rotación, traslación y vibración, además de la energía potencial intermolecular debida a las fuerzas de tipo gravitatorio, electromagnético y nuclear. La energía interna es una función de estado: su variación entre dos estados es independiente de la transformación que los conecte, sólo depende del estado inicial y del estado final.
Al tomar la energía interna como un todo, no es necesario especificar los diferentes tipos de energía intrínsecos de las partículas componentes. Esto significa que cualquiera que sean las interacciones del sistema con los alrededores, la energía que este cede o recibe de ellos se traduce exclusivamente en un aumento o disminución de su energía interna (U) lo cual simplifica extraordinariamente el estudio del sistema y sus interacciones. La energía interna (U) se mide en Joule (J).
PRIMERA LEY O PRIMER PRINCIPIO DE LA TERMODINÁMICA
El primer principio es una ley de conservación de la energía y, a su vez, una definición precisa del calor. Afirma que, como la energía no puede crearse ni destruirse (dejando a un lado las posteriores ramificaciones de la equivalencia entre masa y energía) la cantidad de energía transferida a un sistema en forma de calor más la cantidad de energía transferida en forma de trabajo sobre el sistema debe ser igual al aumento de la energía interna (U) del sistema. El calor y el trabajo son mecanismos por los que los sistemas intercambian energía entre sí.
Q + L = U (1) ó más precisamente: ΔQ + ΔL = ΔU (2)
Cuando un sistema se pone en contacto con otro de menor nivel energético que él, tiene lugar un proceso de igualación de los niveles energéticos de ambos. El primer principio de la termodinámica identifica el calor, como una forma de energía. Puede convertirse en trabajo mecánico y almacenarse. Experimentalmente se demostró que el calor, que originalmente se medía en unidades llamadas calorías, y el trabajo o energía, medidos en joules, eran completamente equivalentes.
En cualquier máquina, hace falta cierta cantidad de energía para producir trabajo; es imposible que una máquina realice trabajo sin necesidad de energía. Una máquina hipotética de estas características se denomina móvil perpetuo de primera especie. La ley de conservación de la energía descarta que se pueda inventar una máquina así. A veces, el primer principio se enuncia como la imposibilidad de la existencia de un móvil perpetuo de primera especie.
El calor, igual que el trabajo, corresponde a energía en tránsito (proceso de intercambio de energía), el calor es una transferencia de energía y puede causar los mismos cambios en un cuerpo que el trabajo. La energía mecánica puede convertirse en calor a través del rozamiento, y el trabajo mecánico necesario para producir 1 caloría se conoce como equivalente mecánico del calor. Según la ley de conservación de la energía, todo el trabajo mecánico realizado para producir calor por rozamiento aparece en forma de energía en los objetos sobre los que se realiza el trabajo. James Prescott Joule fue el primero en demostrarlo de forma fehaciente en un experimento clásico: calentó agua en un recipiente cerrado haciendo girar unas ruedas de paletas y halló que el aumento de nivel energético del agua era proporcional al trabajo realizado para mover las ruedas.
Cuando el calor se convierte en energía mecánica, como en un motor de combustión interna, la ley de conservación de la energía también es válida. Sin embargo, siempre se pierde o disipa energía en forma de calor porque ningún motor tiene una eficiencia perfecta.
SISTEMA y ENTORNO
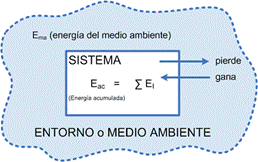
Se tiene un Sistema y su Entorno donde cada uno tendrá una cierta cantidad de energía (que no podemos conocer). A nosotros nos interesan sólo los cambios de energía que se produzcan en el sistema (no en el entorno o medio ambiente aun cuando este juega un papel fundamental para ello).
Es (Energía del Sistema) puede ser mayor, menor o igual que Ema (Energía del Medio Ambiente o Entorno) dependiendo ello de cada situación en particular, pero en determinado momento se producirá un “intercambio de energía, ∆EI” el cual se realizará por medio de calor y trabajo o por uno de ellos. De acuerdo al proceso efectuado, el sistema puede haber ganado o perdido Energía, con lo cual el balance final sería: Es final – Es inicial = ∑EI o lo que es lo mismo: ∆Es = ∑EI Graficamos esta situación de la siguiente forma:
Esto nos indica que la variación de Energía del Sistema (nuestro objetivo al analizar la primera ley) es igual a la suma algebraica de las energías intercambiadas o en proceso de intercambio, siendo la energía acumulada aquella que no participa en estos procesos.
Por otra parte si bien hay un intercambio de Energía entre Sistema-Medio Ambiente siempre se cumple la ley de conservación de la energía ya que:
1.- antes del intercambio: Es i + Ema i = E universo siendo i= inicial
2.- luego del intercambio: Es f + Ema f = E universo siendo f= final
Donde: Esf - Esi = ∆Es = ∑E intercambiadas
*En ambos casos la energía del universo se mantiene constante.
CUESTIONARIO:
1-
¿Cómo se define la energía según el artículo?
2- ¿Qué se produce en un sistema que pasa de un estado a otro?
3- Sintetizar el primer principio de la termodinámica.
4- ¿Cómo pueden manifestarse las transformaciones de la energía?
5- ¿Qué es la energía interna de un sistema? ¿En qué unidad se mide?
6- ¿Se puede conocer la energía del sistema y la del entorno? Explicar
7- ¿Qué es la variación de energía de un sistema?
8- Efectúe mapa conceptual
*Fuentes
http://www.fisicanet.com.ar/fisica/termodinamica/ap04_primer_principio.php



Comentarios
Publicar un comentario