P. JOULE - EL EQUIVALENTE MECÁNICO DEL CALOR
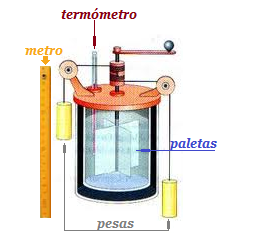
LOS EXPERIMENTOS DE JOULE. LA DINÁMICA DEL CALOR Cerca de medio siglo después James Prescott Joule repetiría los experimentos de Rumford a una escala menor. Comenzó en los años cuarenta del siglo XIX y los repitió durante muchos años, refinando cada vez más sus aparatos y sus técnicas. En todos los casos, cuanto más cuidadoso era más exacta encontraba la proporcionalidad de la cantidad de calor, medida como cambio en la temperatura y la cantidad de trabajo realizado. Como Joule hacía sus experimentos con agua, como el resto de investigadores de la época, asumía que la proporcionalidad que encontraba entre la cantidad de calor producida, simbolizada por la letra Q (Q es un símbolo habitual para el calor) era igual a la cantidad de agua expresada como su masa, m, multiplicada por el cambio (que se simboliza con la letra griega Δ, delta) de la temperatura, T; con lo que llegaba a la expresión: Q = m·ΔT. Hoy sabemos que la cantidad de calor que corresponde a un determinado cambio de te
